天津医科大学基础医学院石磊教授课题组近期在《Genome Biology》和《Molecular Cell》杂志发表了题为LAP2apreserves genome integrity through assisting RPA deposition on damaged chromatin和A PARylation-phosphorylation cascade promotes TOPBP1 loading and RPA-RAD51 exchange in homologous recombination的研究论文,分别揭示了核纤层相关蛋白LAP2a调节RPA在ssDNA上沉积的重要功能,以及多聚(ADP-核糖)化和磷酸化级联反应调节同源重组过程中RPA-RAD51交换的分子机理。
真核细胞的每个细胞周期中,遗传物质不断受到内源性或外源性的攻击,这些因素会破坏遗传信息的完整性。在生理环境下,温和的复制压力以较低水平存在;然而在病理状态下,致瘤转化和化疗药物可进一步诱导复制压力的累积,导致基因组不稳定性加剧。一般来说,细胞内存在多种阻碍复制叉前进的因素,包括DNA损伤、转录复制碰撞、DNA-RNA杂交链和染色质高级结构等。如果复制压力持续存在,停滞的复制叉可能崩溃进而产生DNA双链断裂(Double-strand breaks,DSBs),严重的威胁基因组的完整性。虽然这些复杂的结构可能会有很大的不同,但它们都会形成被复制蛋白A(Replication protein A, RPA)覆盖的长片段的单链DNA(single strand DNA, ssDNA),这个普遍存在的中间产物为维持基因组稳定因子的招募和交换提供了一个平台,以应对复制压力或修复DSBs,完成基因组稳定性监测通路的协调和运筹。RPA是由RPA1、RPA2以及RPA3构成的异源三聚体,与ssDNA有亚纳摩尔级的亲和力;在细胞中发挥着保护ssDNA不被核酸酶降解、破坏以及形成二级结构的功能。然而,在哺乳动物细胞中,复制压力或DNA损伤过程中调节RPA在ssDNA上沉积的机制,目前尚不清楚。
作者通过定量质谱等一系列实验方法发现LAP2a可以与RPA1相互作用。LAP2a通过其LEM-like和LEM结构域之间的linker(a.a 76-107)与RPA三元复合物中RPA1的DBD-A结构域结合,该区域中的精氨酸R86和R88是负责LAP2a与RPA相互作用的关键氨基酸。依赖于这种结合模式,LAP2a可以促进RPA于损伤染色质沉积、保护复制叉、激活ATR和修复断裂的DNA。作者进一步证明,LAP2a促进RPA沉积在受损的染色质上取决于多聚(ADP-核糖)聚合酶1(poly ADP-ribose polymerase, PARP1)本身,而不是其多聚(ADP-核糖)化酶活性。
该研究发现了一种哺乳动物细胞中促进RPA结合ssDNA的重要调节因子,解释了为何LAP2a偏向于在复制压力位点乃至DNA断裂位点沉积RPA的分子机理,为探究RPA-ssDNA复合物形成的调控机制以及基因组稳定性维持提供了重要启示,同时也为复制压力异常相关疾病如肿瘤等的治疗提供了潜在靶点。天津医科大学基础医学院博士研究生包凯文,西安交通大学第一附属医院张琦博士,天津医科大学基础医学院刘帅和总医院宋囡博士是该论文的共同第一作者。天津医科大学基础医学院石磊教授为该论文通讯作者。
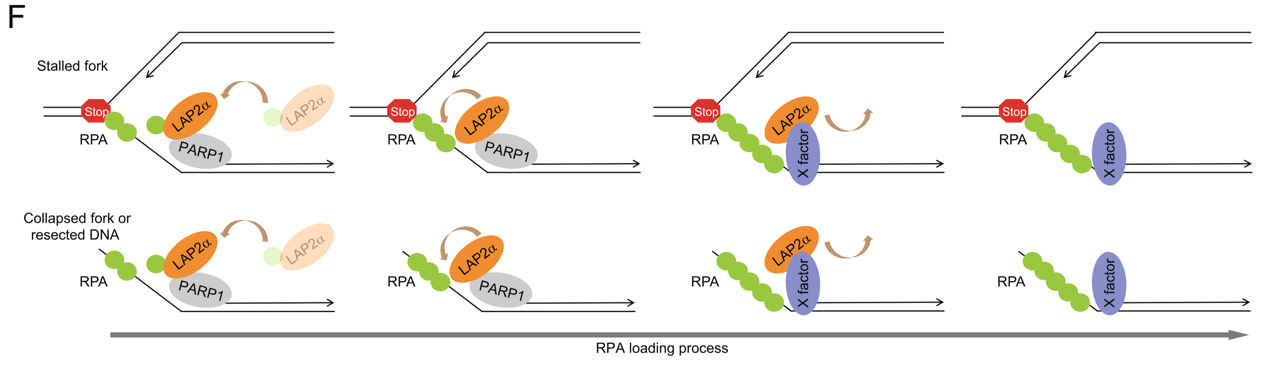
工作模型
同源重组(Homologous recombination,HR)是修复DNA双链断裂(DSBs)的高保真途径,不仅在基因组稳定性维持中发挥重要作用,也与肿瘤发生发展和放化疗敏感性密切相关。HR利用同源序列进行修复,主要活跃在S-G2期。HR反应从DNA末端加工开始,产生3’端裸露的ssDNA。RPA迅速包裹ssDNA,然后被重组因子RAD51取代。因为RPA对ssDNA的亲和力比RAD51更高,所以RAD51在ssDNA上的组装需要一系列调控蛋白介导。其中,BRCA2是RAD51-ssDNA生成的最经典调节因子;此外,组蛋白伴侣分子ASF1和CAF1可以依赖MMS22L-TONSL复合物调节RAD51-ssDNA的形成;TOPBP1(DNA Topoisomerase II Binding Protein 1)可通过促进PLK1激酶介导的RAD51磷酸化,帮助RAD51结合ssDNA。这些研究表明细胞中存在多种独立或相互联系的机制调控RAD51核丝组装。RPA-ssDNA作为HR过程中DNA损伤修复蛋白质机器招募和解离的重要平台,在以往研究中备受关注。然而,是否存在可将RPA沉积和RAD51核丝生成联系起来的中间调控事件,仍需要进一步探究。
TOPBP1含有多组成对出现的BRCT(BRCA1 C-terminal)结构域,它们负责识别不同磷酸化形式或者非磷酸化的配体蛋白,决定了TOPBP1在复制起始或复制压力应答中的特异性工作模式。这些蛋白包括PHF8(Sci Adv. 2021 May 5;7(19):eabf7684,天津医科大学马帅博士等为论文第一作者)、53BP1、MDC1以及BLM等。然而,在HR倾向性的DSBs染色质区域,TOPBP1是如何被募集的尚不清楚。作者发现HTATSF1(HIV Tat-specific factor 1)在活跃复制细胞中高表达,是S期TOPBP1相互作用蛋白;HTATSF1 C端S748位点以CK2激酶依赖的磷酸化形式与TOPBP1 BRCT 0-2结构域结合,BRCT 0-2的K250位点负责阅读S748磷酸化修饰。以往研究表明,K250位点也是TOPBP1识别DDR(DNA damage response)分子53BP1和MDC1的关键氨基酸残基。与之不同的是,HTATSF1主要控制S期TOPBP1在损伤染色质上的募集。此外,该事件并不依赖HTATSF1的RNA结合或加工活性。作者进一步研究发现HTATSF1利用N端RRMs(RNA recognition motif)识别多聚(ADP-核糖)化的RPA,借此将HTATSF1-TOPBP1复合体直接招募到RPA-ssDNA平台,进而促进RAD51核丝生成和RPA解离。
该研究揭示了多聚(ADP-核糖)化和磷酸化级联反应调控TOPBP1在HR倾向性损伤染色质募集以及RPA-RAD51交换中的重要作用,发现了PARP1在HR修复中的新功能,提示TOPBP1 BRCT 0-2磷酸化配体蛋白结合口袋可能成为潜在的肿瘤治疗靶点。天津医科大学基础医学院博士研究生赵娇,田姗姗老师,硕士研究生郭秋识和博士研究生包凯文是该论文的共同第一作者。天津医科大学基础医学院石磊教授、张锴教授和马帅博士为该论文通讯作者。
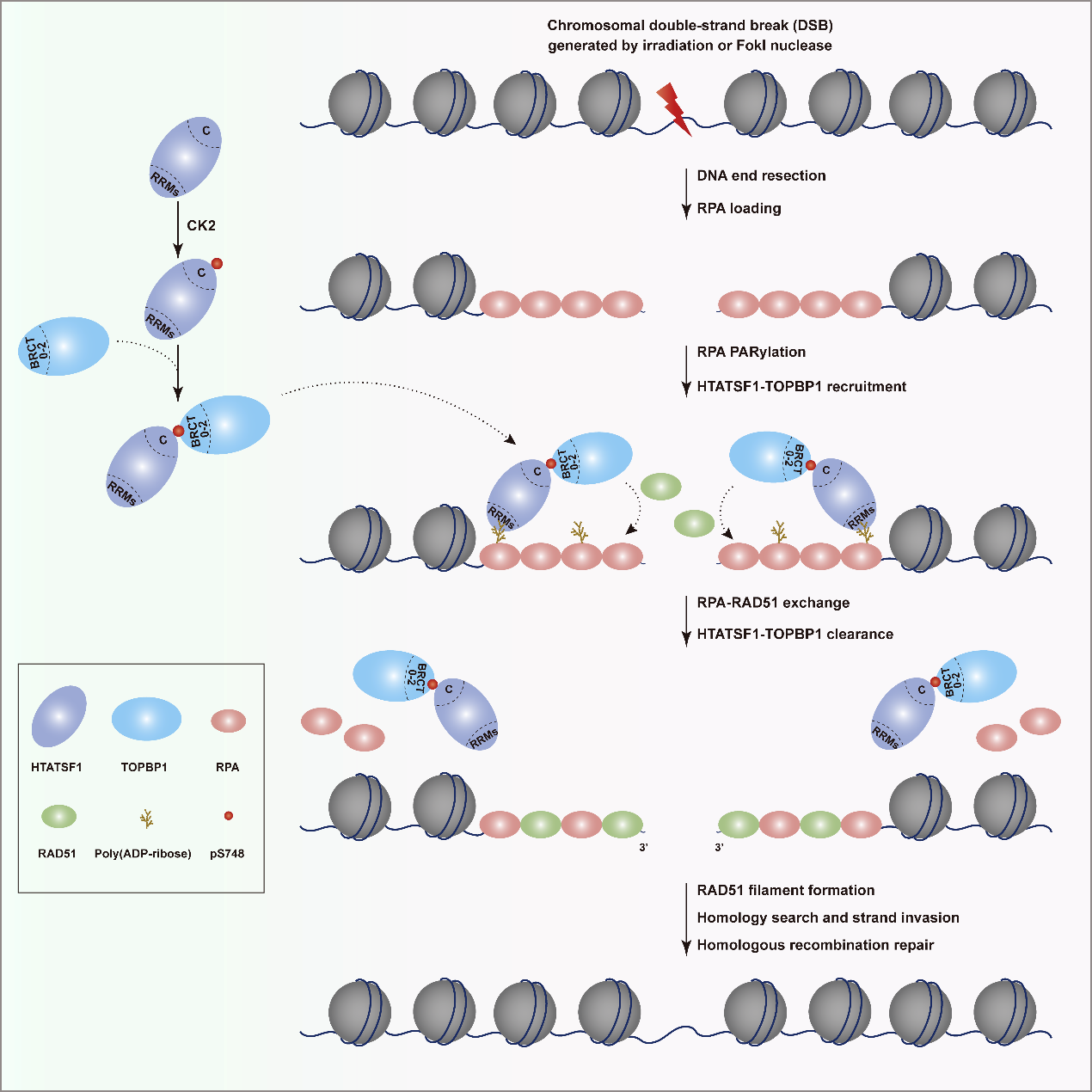
工作模型
天津医科大学姚智教授、朱毅教授、郝继辉教授、艾玎教授、杨洁教授、刘喆教授,南开大学杨娜教授等为以上研究提供了重要帮助和支持。以上研究得到了科技部重点研发计划,国家自然科学基金委优秀青年基金、面上项目,实验血液学国家重点实验室以及细胞生态海河实验室的资助。
[作者介绍]

石磊,天津医科大学基础医学院教授,卓越人才计划PI。教育部长江学者青年学者,国家自然科学基金优秀青年科学基金获得者,教育部新世纪优秀人才。

