近日,天津医科大学基础医学院王玲娣和朱路教授团队在国际肿瘤学刊物《Oncogene》杂志发表了题为“Retrograde regulation of mitochondrial fission and epithelial to mesenchymal transition in hepatocellular carcinoma by GCN5L1”的研究论文,揭示了GCN5L1参与线粒体逆向信号调控在线粒体裂变和肝癌转移中的作用和分子机制,为肝癌治疗提供了一个新的潜在治疗靶点。
肝细胞癌(HCC)是一种常见的恶性肿瘤类型,5年生存率低于20%,肝癌的死亡率在癌症中排第三位。探究肝癌发生和转移的分子机制对于改进肝癌的治疗和诊断方案,提高生存率具有重要的临床意义。GCN5L1所调节的线粒体蛋白乙酰化参与了线粒体代谢的重要调节过程,这与癌细胞的迁移和侵袭密切相关。而代谢重编程可以调控癌细胞的生长和迁移以及决定细胞的发展命运。
课题组2022年5月发表在《Clinical and Translational Medicine》上题为“Mitochondrial GCN5L1 regulates glutaminase acetylation and hepatocellular carcinoma”的研究论文指出:GCN5L1通过抑制谷氨酰胺酶1/2(GLS1/2)的乙酰化,减少了该酶低聚物的形成,使其蛋白活性降低,进而抑制了mTOR的活性和肝癌的发生。但是HCC的进展除了肿瘤增长还包括肝内浸润和肝外转移,而转移是影响HCC预后的主要风险因素。
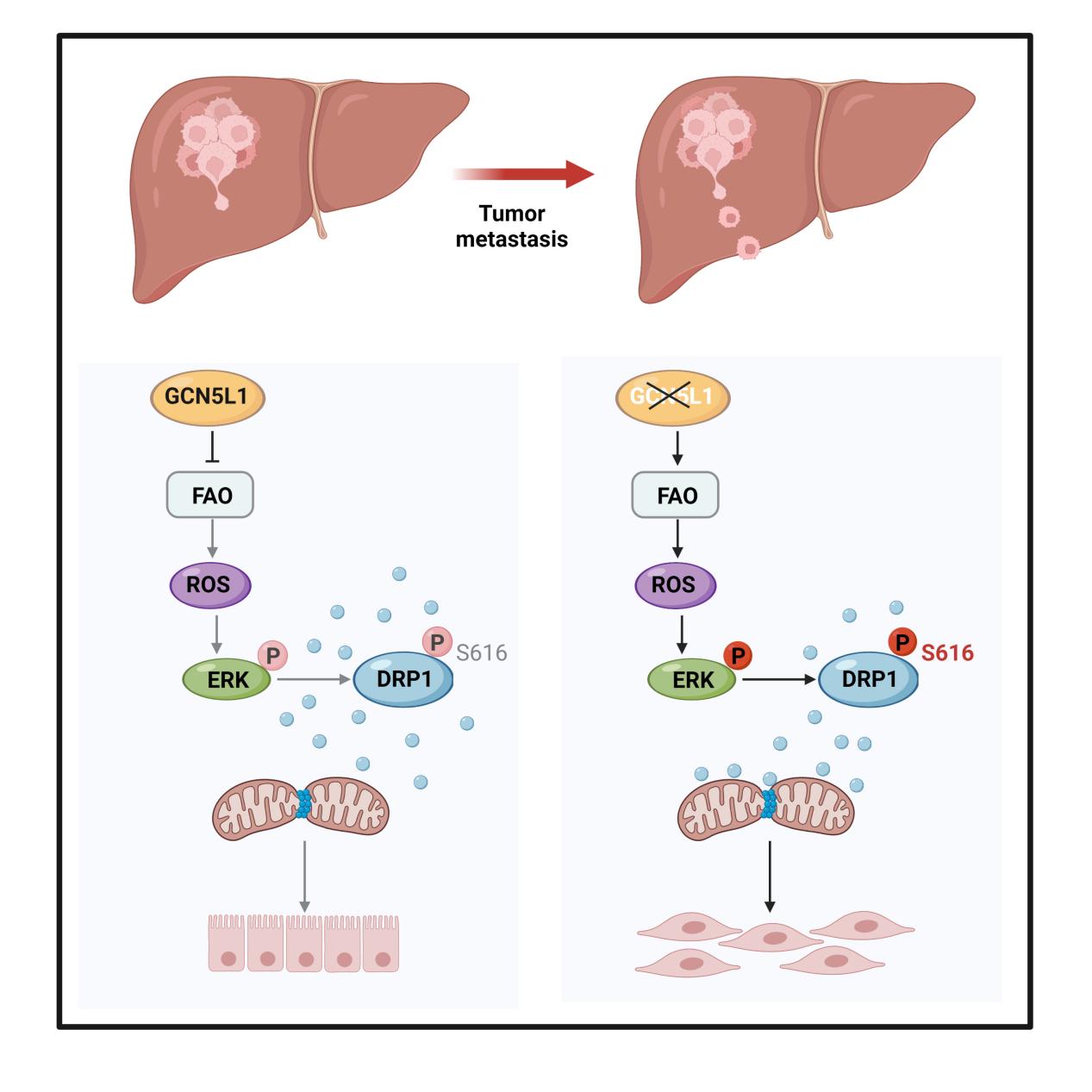
本研究通过进一步的小鼠体内及体外功能学实验发现,GCN5L1可以抑制肝癌的转移和EMT的发生。对肝癌相关数据库进行分析,还发现转移性HCC组织中GCN5L1的表达显著降低,证明GCN5L1延缓了肝癌的转移。为了探索GCN5L1调节肝癌转移的机制,对GCN5L1敲除细胞的线粒体功能进行分析,发现GCN5L1的敲除使线粒体明显碎片化,且线粒体裂变相关蛋白(DRP1)的丝氨酸616位点的磷酸化明显增强,导致从胞质中转移到线粒体的DRP1显著增加进而介导了线粒体裂变。通过转录组学分析,发现GCN5L1敲除细胞的氧化应激通路被显著激活,活性氧ROS水平明显增加,且促进了线粒体的裂变。进一步探索ROS的来源,发现GCN5L1敲除诱导的ROS产生来源于脂肪酸氧化(FAO),且FAO关键酶肉毒碱棕榈酰基转移酶2(CPT2)和长链酰基辅酶A脱氢酶(LCAD)的乙酰化水平明显降低,酶活性明显增加。因此,该研究揭示了GCN5L1及线粒体代谢在HCC转移中的抑制作用及潜在的分子机制,也为脂质代谢调控肝癌转移提供了新的证据。
本研究由天津医科大学基础医学院王玲娣教授和朱路教授共同指导,博士生韩林勐为该文章第一作者,研究获得国家自然科学基金重大研究计划培育项目(糖脂代谢的时空网络调控)、面上项目、天津医科大学卓越人才计划的支持。该研究工作的合作单位包括:天津医科大学朱宪彝纪念医院和内分泌研究所、天津市炎症生物学重点实验室、国家卫健委激素与发育重点实验室等。
原文链接:https://rdcu.be/c5gwZ
【作者介绍】

王玲娣,天津医科大学基础医学院教授、博导。2020年10月加入天津医科大学基础医学院生理学与病理生理学系。研究线粒体功能异常在代谢性疾病和肿瘤发生发展中的作用和机制,研究成果发表在《NatureCommunications》、《Hepatology》、《Clinical TranslationalMedicine》和《Oncogene》等杂志。
热忱欢迎各位老师、同学合作交流。

